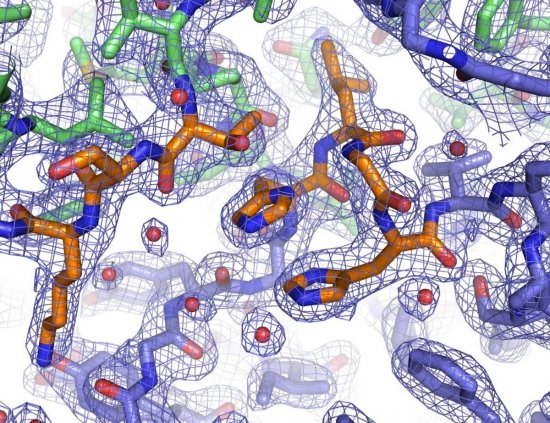
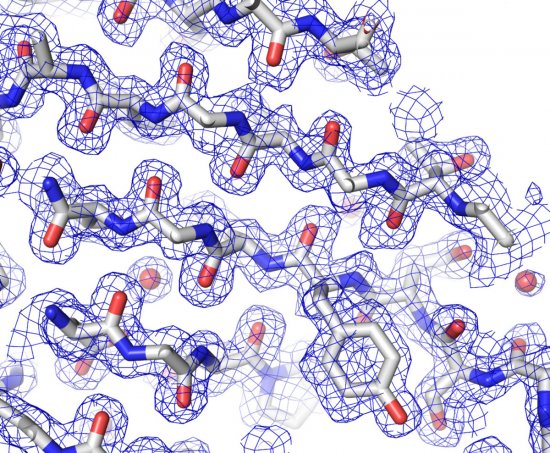
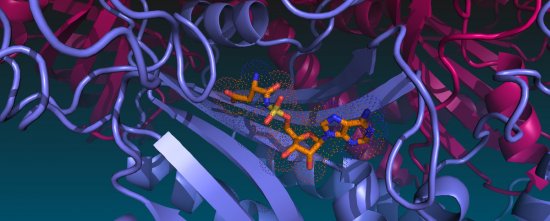
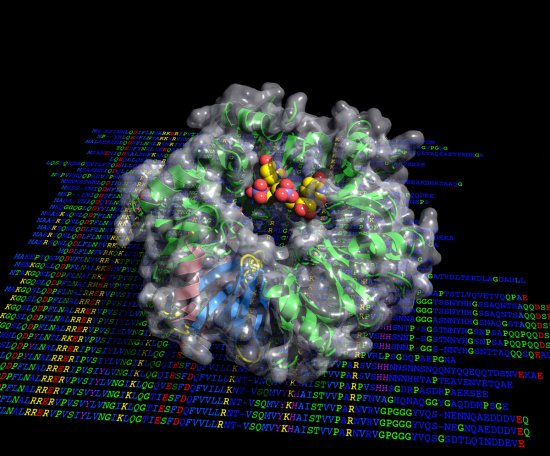
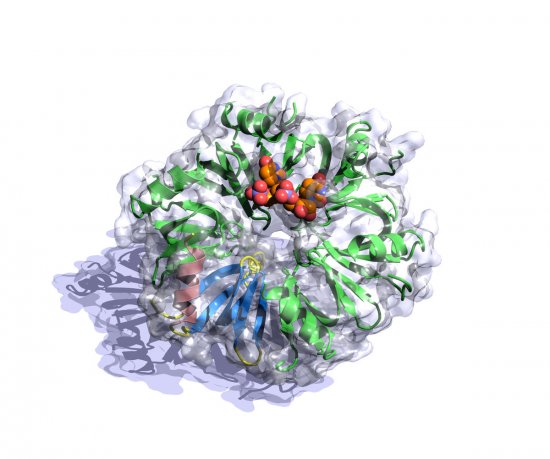
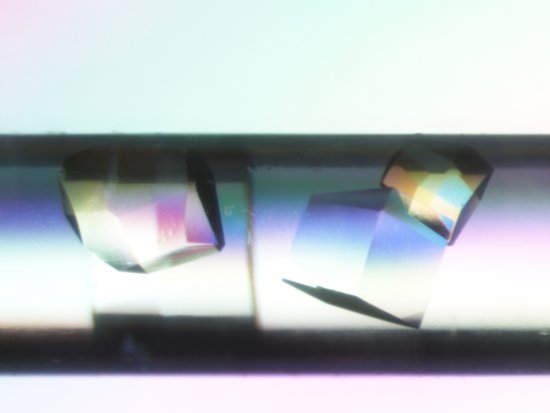Reportage Photo
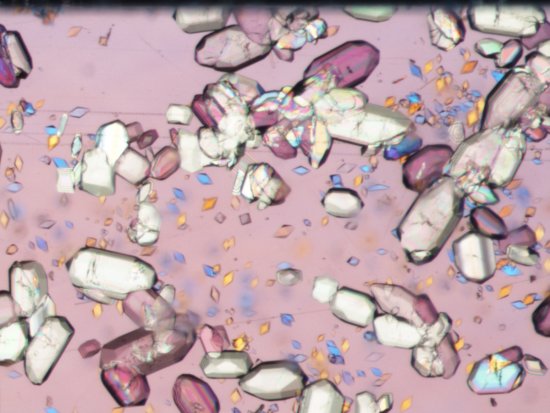
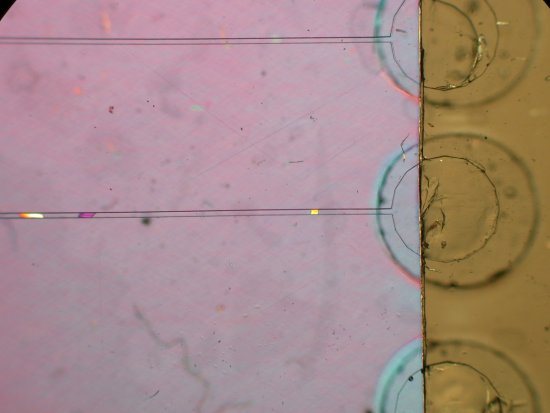
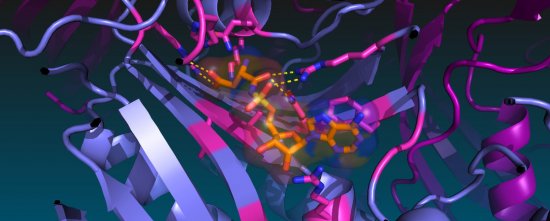
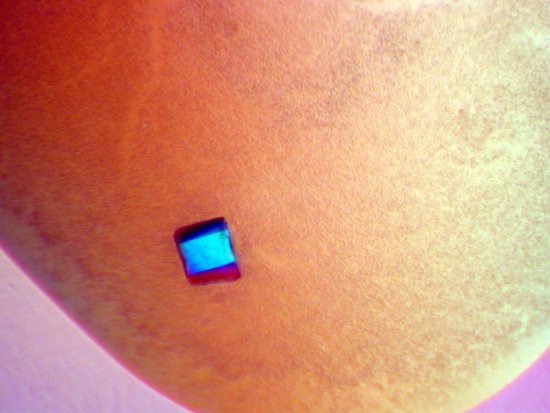
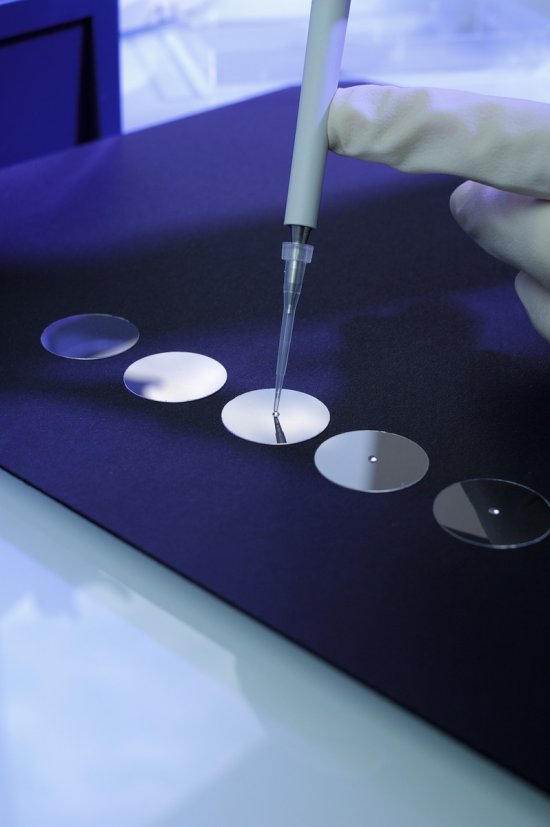
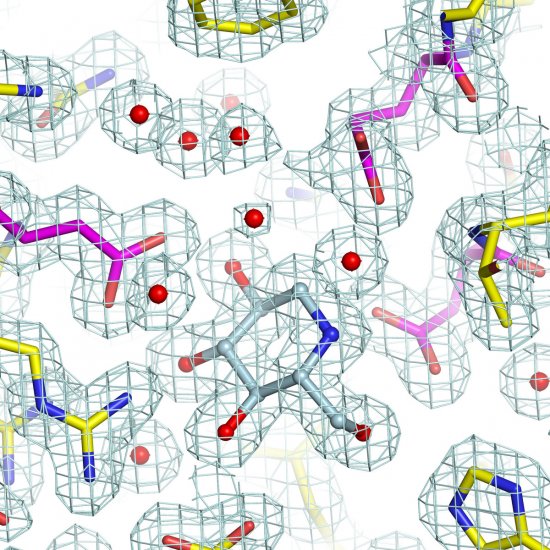
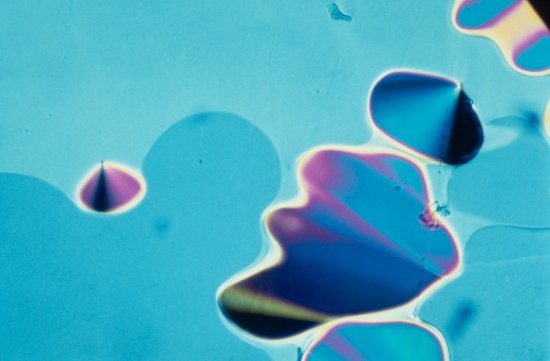
Cristallographie ibmc

Thématiques scientifiques
CNRS Images,
Nous mettons en images les recherches scientifiques pour contribuer à une meilleure compréhension du monde, éveiller la curiosité et susciter l'émerveillement de tous.