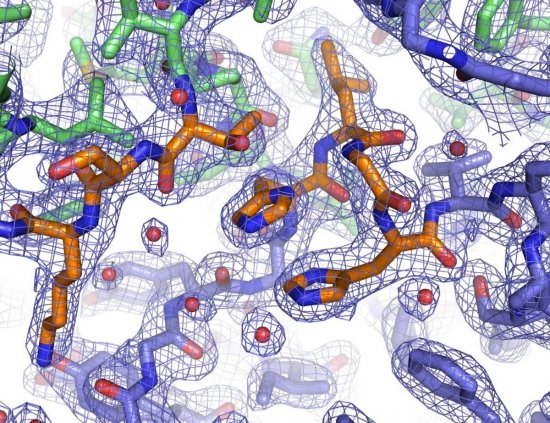
Photo report
IBMC Crystallography

CNRS Images,
Our work is guided by the way scientists question the world around them and we translate their research into images to help people to understand the world better and to awaken their curiosity and wonderment.