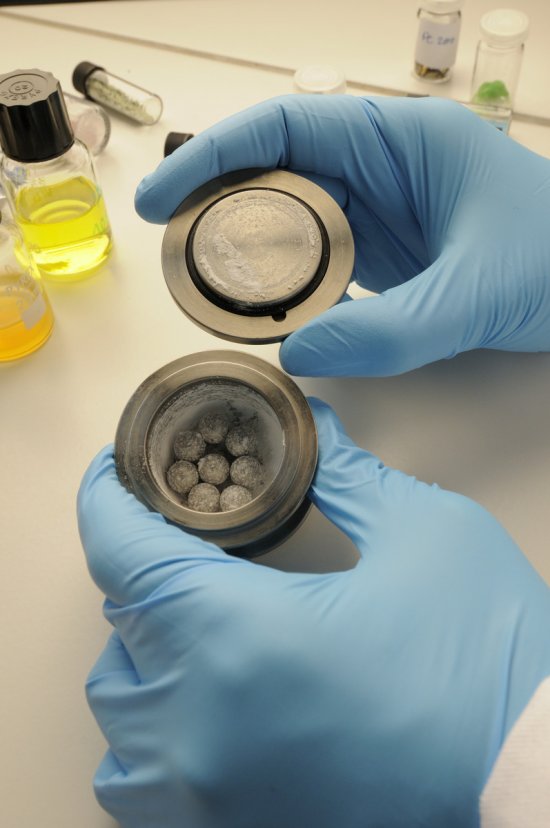
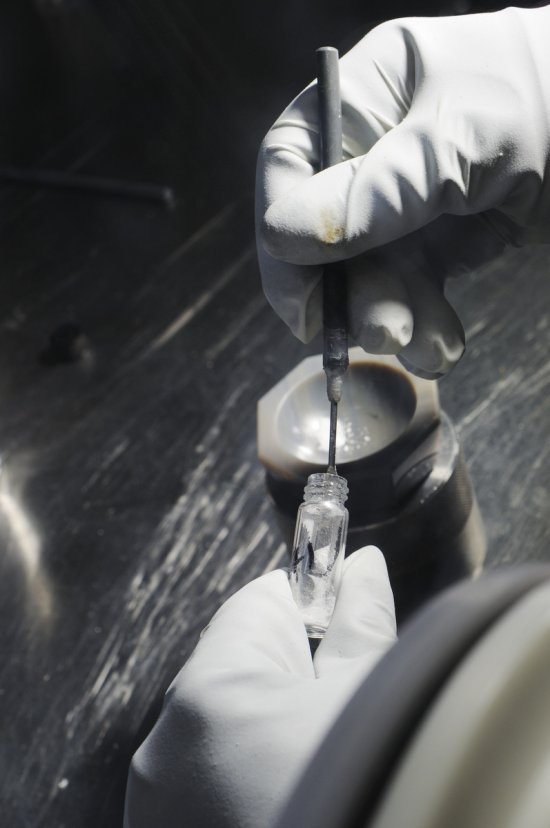
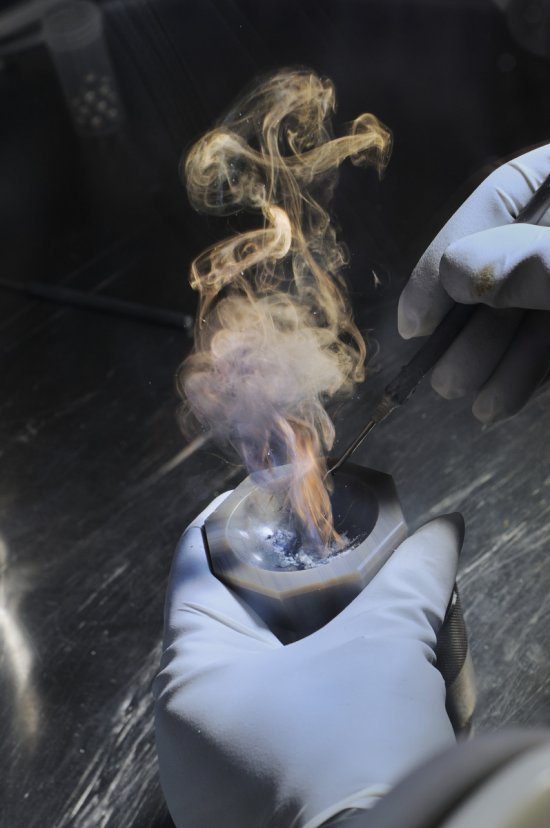
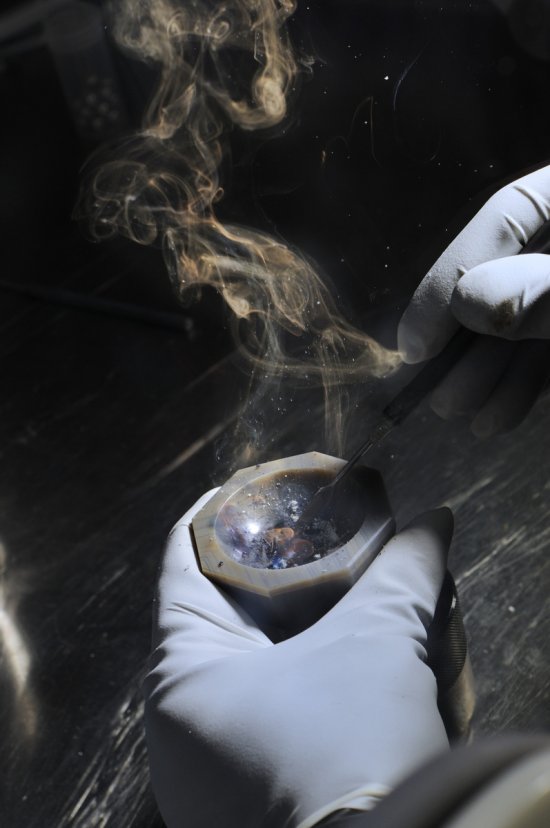
Emmanuel PERRIN
Photographe indépendant depuis plus de 25 ans, Emmanuel Perrin travaille pour la publicité et la communication institutionnelle. Il a ainsi abordé de très nombreux sujets, dans l’industrie et l’automobile. Sa longue collaboration avec le CNRS l’a conduit dans les laboratoires de recherche. Ses sujets de prédilection sont le portrait, le paysage, et la nature morte. Il publie régulièrement des commandes pour la presse magazine (Télérama, l'Express, Ciel et Espace, Lire, Terre de Vins).
Depuis son installation dans le sud de la France, une partie importante de son travail est consacrée au monde du vin. Ces dernières années, il développe également une activité d'enseignement de la photographie. Son travail personnel a déjà été présenté lors de plusieurs expositions, à Paris et en région. Lauréat 2012 du Grand Prix Terroir d'Images. Livres parus aux Éditions de La Martinière et aux Éditions Sud-Ouest.